- Un equipo liderado por la Dra. Margarita Díaz-Guerra del IIBM identifica un nuevo mecanismo implicado en el ictus isquémico y desarrolla una terapia innovadora probada con éxito en modelos preclínicos
El grupo de investigación Herramientas Diagnósticas y de Neuroprotección en Excitotoxicidad e Isquemia Cerebral dirigido por la Dra. Margarita Díaz-Guerra en el Instituto de Investigaciones Biomédicas Sols-Morreale (CSIC-UAM), ha publicado en la revista Theranostics un hallazgo clave en la comprensión del ictus isquémico. Su estudio revela un nuevo mecanismo que regula el daño neuronal y la activación de células gliales —como los astrocitos y la microglía—, abriendo la puerta a una novedosa terapia que ya ha mostrado eficacia en modelos preclínicos de esta forma de daño cerebral.
El ictus cerebral tiene enorme relevancia sociosanitaria y económica al ser una de las principales causas de muerte, siendo la primera causa de discapacidad en adultos y la segunda de demencia. El ictus isquémico, el tipo más frecuente, se produce por la interrupción del flujo sanguíneo en el cerebro. Aunque tratamientos como la trombólisis o la trombectomía mecánica han supuesto avances significativos, solo pueden aplicarse a una minoría de pacientes. Por eso, muchos esfuerzos actuales se centran en proteger la llamada zona de penumbra isquémica: el tejido cerebral que rodea al área del infarto y que aún puede salvarse.
“Si no se actúa con rapidez, las neuronas de la zona de penumbra pueden morir como consecuencia de un proceso llamado excitotoxicidad, que interfiere con el soporte que brindan las neurotrofinas, crucial para la supervivencia neuronal”, explica la Dra. Díaz-Guerra. Otro factor clave en el avance del daño cerebral es la inflamación, iniciada por la activación de células inmunitarias residentes en el cerebro, como los astrocitos y la microglía.
En investigaciones anteriores, el grupo ya había demostrado que el receptor truncado de neurotrofinas TrkB-T1 —presente principalmente en neuronas y astrocitos— desempeña un papel fundamental tanto en la excitotoxicidad como en el daño isquémico. Curiosamente, 11 de los 23 aminoácidos que forman la región intracelular del receptor TrkB-T1 constituyen una secuencia exclusiva de esta variante que está altamente conservada entre especies. “Pensamos que esta secuencia podría mediar interacciones con otras proteínas que contribuyen a la neurotoxicidad y la neuroinflamación. Si esto fuese así, podría representar una diana terapéutica frente al ictus”, explica Lola Ugalde-Triviño, primera autora del estudio e investigadora predoctoral en el IIBM.
Para comprobarlo, el equipo diseñó unos péptidos especiales llamados cell-penetrating peptides, que contenían la secuencia específica de TrkB-T1. Estos péptidos fueron capaces de atravesar la barrera hematoencefálica —una de las principales dificultades para tratar el cerebro con fármacos—, alcanzando tanto neuronas como astrocitos. Al utilizar dichos péptidos en cultivos primarios de estos tipos celulares, lograron aislar e identificar las proteínas que interactuaban con los péptidos, revelando por primera vez un interactoma específico de TrkB-T1 en condiciones normales y de excitotoxicidad.
Pero lo más relevante llegó después: el tratamiento con estos péptidos no solo redujo la activación de células gliales, sino también la muerte neuronal inducida por excitotoxicidad. Este efecto se observó tanto en cultivos primarios de cerebro como en modelos preclínicos de ictus. En estos últimos, el uso de los péptidos redujo significativamente el volumen del infarto en ratones macho y hembra. En los machos, además, esta reducción se asoció con una mejora en el rendimiento neurológico en pruebas de coordinación motora y equilibrio. En las hembras, no pudo establecerse dicha asociación ya que mostraban buen rendimiento neurológico con volúmenes similares de infarto, lo que sugiere diferencias de respuesta entre sexos.
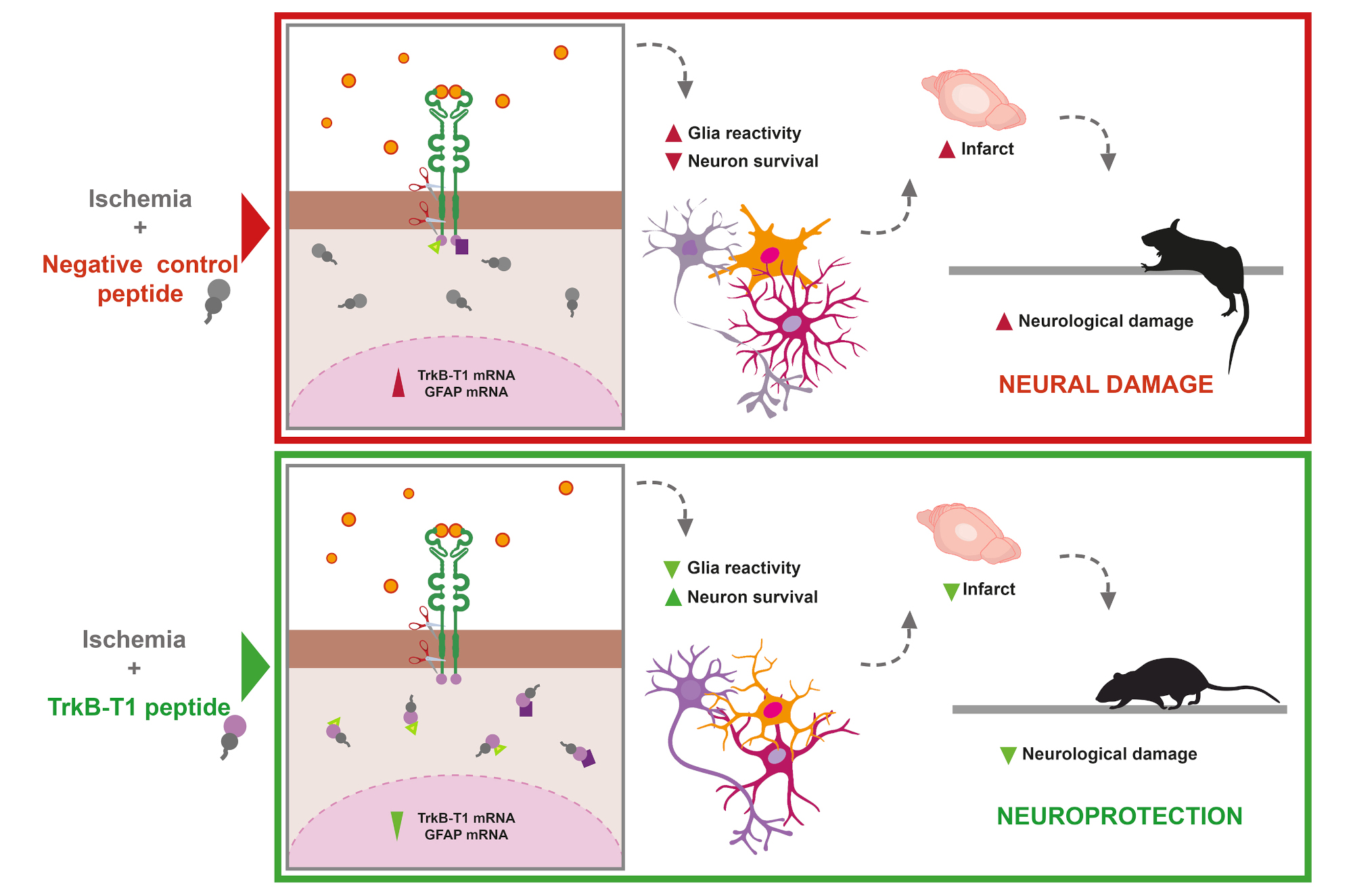
La imagen muestra cómo actúan los péptidos protectores diseñados a partir de secuencias específicas del receptor TrkB-T1, según el modelo propuesto por el equipo de investigadores.
Más allá del ictus, el péptido desarrollado podría tener aplicaciones terapéuticas en otras patologías, ya que la excitotoxicidad es un proceso común tanto en daños agudos (ictus, lesiones medulares o cerebrales) como en enfermedades neurodegenerativas crónicas. Además, también juega un papel en trastornos que afectan a la audición o la visión.
Junto a Lola Ugalde-Triviño, han participado en esta investigación el Dr. Gonzalo S. Tejeda, de la School of Molecular Biosciences, University of Glasgow, y la Dra. Gema M. Esteban-Ortega, actualmente en el Centro de Biología Molecular Severo Ochoa (CBMSO). El trabajo ha sido financiado por la Agencia Estatal de Investigación (PID2019-105784RB-100 y PID2022-137710OB-I00).
Referencia del artículo: Lola Ugalde-Triviño, Gonzalo S. Tejeda†, Gema M. Esteban-Ortega† y Margarita Díaz-Guerra. A brain-accessible peptide modulates stroke inflammatory response and neurotoxicity by targeting BDNF-receptor TrkB-T1 specific interactome. Theranostics, 2025. https://www.thno.org/v15p4654.htm
Imagen de portada: Cerebro de ratón sometido a 24 h de isquemia focal permanente; se muestran los astrocitos reactivos GFAP+ (magenta), formando la conocida como cicatriz glial en regiones adyacentes al núcleo del infarto.