- Un estudio liderado por la Dra. Silvia Martín-Puig descubre el papel clave de HIF2 en la protección del sistema cardiovascular durante la hipoxia crónica
- La función protectora de HIF2 podría condicionar el diseño de nuevas terapias contra la hipertensión pulmonar
El grupo de Homeostasis del Oxígeno en el Sistema Cardiovascular dirigido por la Dra. Silvia Martín-Puig, en el Instituto de Investigaciones Biomédicas Sols-Morreale (IIBM) CSIC-UAM ha publicado recientemente en la revista Arteriosclerosis, Thrombosis, and Vascular Biology un estudio que describe un papel fundamental del factor inducible por hipoxia HIF2 durante la adaptación cardiaca y pulmonar a periodos de bajo oxígeno sostenidos, lo que se conoce como hipoxia crónica. Los investigadores describen cómo la señalización cardiopulmonar mediada por HIF2 previene la proliferación vascular excesiva durante periodos de hipoxia mantenida, garantizando la estabilidad de la microvasculatura y la función de estos órganos esenciales.
La hipoxia está asociada a la aparición de diversas enfermedades cardiovasculares como la hipertrofia cardiaca y la hipertensión pulmonar. En concreto, se ha descrito previamente que la señalización mediada por HIF2 en el endotelio pulmonar promueve el remodelado arterial y la consiguiente elevación de la presión sistólica del ventrículo derecho en condiciones de bajo oxígeno, siendo un factor promotor de la progresión de hipertensión pulmonar. Por ello, recientemente se han propuesto nuevas oportunidades terapéuticas contra esta patología basadas en inhibidores específicos de HIF2. Sin embargo, la falta de estudios dirigidos a evaluar la función de HIF2 en otros tipos celulares más allá del endotelio pulmonar, así como la ausencia de trabajos sobre el papel de HIF2 en corazón, impiden anticipar las posibles consecuencias de una inhibición sistémica de la vía de HIF2 en condiciones de hipoxia sostenida, característica de algunas patologías pulmonares. “Nuestro trabajo se basa en la caracterización de un nuevo modelo de ratón genético de deleción de HIF2 en todo el linaje vascular cardiaco y pulmonar, incluyendo endotelio, pericitos y células de músculo liso, cubriendo así un espectro celular más amplio que el disponible hasta el momento, lo que nos ha permitido predecir potenciales efectos adversos del tratamiento basado en inhibidores de HIF2”, explica la investigadora y primera autora del trabajo Teresa Albendea-Gómez.
Utilizando este modelo animal, los autores del trabajo confirman la protección del mutante de HIF2 en cuanto al remodelado arterial pulmonar y subsiguiente elevación de la presión sistólica del ventrículo derecho, en consonancia con investigaciones previas. Sin embargo, frente a este beneficio de eliminar HIF2, “nuestro trabajo revela que en ausencia de HIF2 la exposición sostenida a periodos de bajo oxígeno – protocolo aceptado para recapitular hipertensión pulmonar en roedores- provoca graves alteraciones pulmonares, incluyendo engrosamiento pleural, congestión alveolar, inflamación y hemorragias pulmonares” explica Silvia Martín-Puig. “Asimismo, los ratones deficientes en HIF2 presentan cardiomegalia, remodelado capilar, hipertrofia y dilatación ventricular, así como disfunción sistólica, lo que sugiere que HIF2 desempeña funciones cardioprotectoras esenciales en hipoxia que son directas e independientes de su papel en pulmón”, continua la investigadora. Estos defectos estructurales se restauran parcialmente tras 1 semana de reoxigenación, mientras que los parámetros funcionales cardíacos permanecen alterados.
Estos hallazgos revelan funciones protectoras de HIF2 no esperables en base a la literatura previa y demuestran la relevancia de la estabilidad microvascular dependiente de HIF2 para prevenir congestión pulmonar y disfunción cardiaca en condiciones de hipoxia. Además, los resultados de este trabajo ponen de manifiesto las serias complicaciones en el sistema cardiovascular que podrían asociarse al tratamiento farmacológico utilizando inhibidores de HIF2 que ya han sido propuestos como opciones terapéuticas, no sólo para hipertensión pulmonar, sino para ciertos carcinomas renales de célula clara.
Esta investigación se ha llevado a cabo con la colaboración del Centro de Investigaciones Biológicas Margarita Salas (CIB-CSIC), el Centro Nacional de Investigaciones Cardiovasculares (CNIC) y la Universidad Complutense de Madrid (UCM), y ha sido financiado por el Ministerio de Ciencia e Innovación (PID2020‐117629RB‐I00), la Fundación Domingo Martínez (CARDIO.COM) y la Comunidad de Madrid (P2022/BMD-7245).
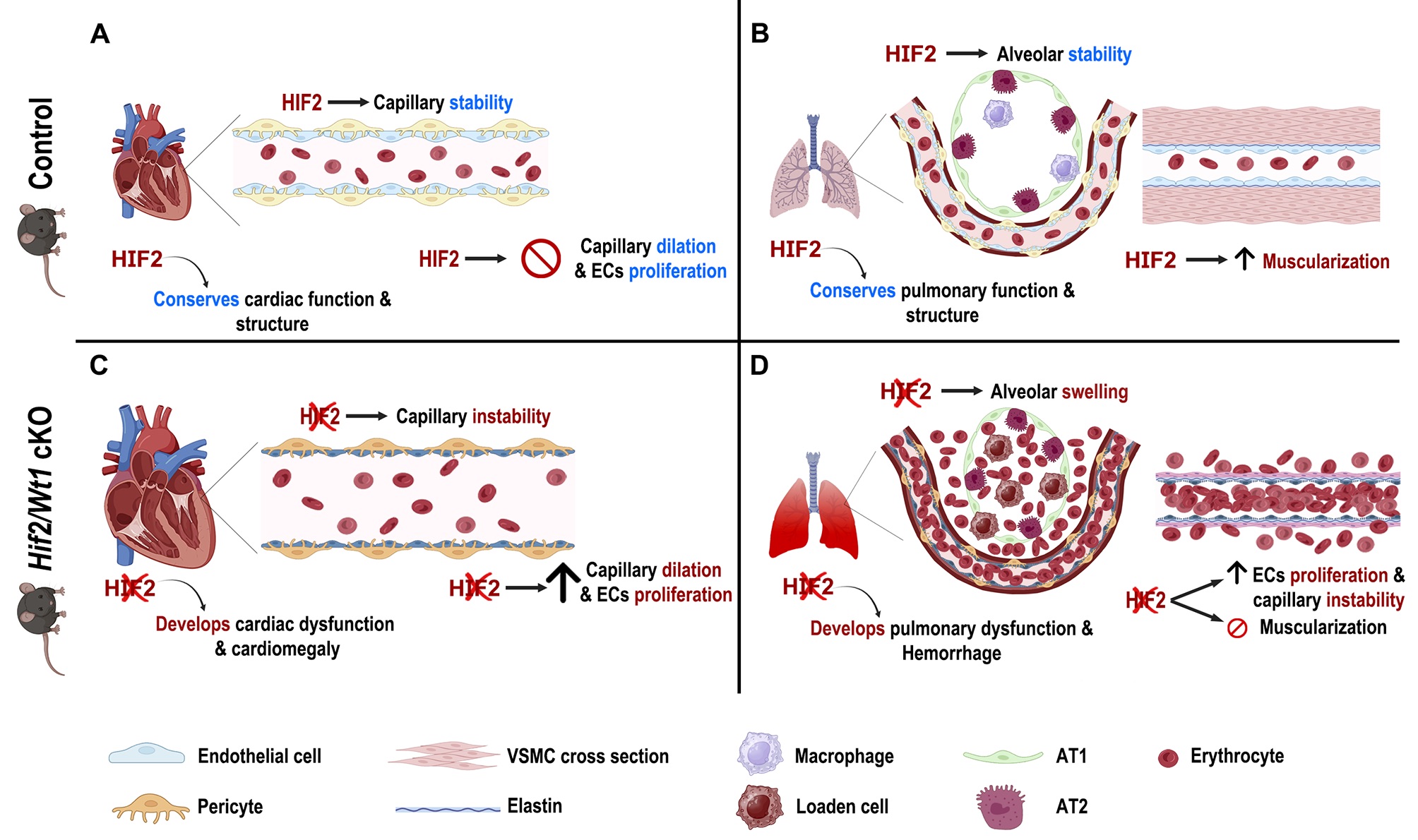
Figura: Animales control con HIF2 intacto están protegidos del desarrollo de cardiomegalia (aumento del tamaño del corazón) asociado a la dilatación capilar y proliferación de células endoteliales en respuesta a hipoxia (A). Sin embargo, la pérdida de HIF2 resulta en la aparición de cardiomegalia secundaria a la dilatación capilar y proliferación endotelial, lo que conduce a disfunción cardiaca en hipoxia (C). Por otro lado, los pulmones de animales control, presentan una estructura conservada del parénquima alveolar en hipoxia, aunque muestran un profundo remodelado arterial (muscularización) mediado por HIF2 (B). En cambio, ratones deficientes en HIF2 están protegidos de dicha muscularización y de un exceso de proliferación endotelial, pero presentan defectos estructurales graves como congestión pulmonar por eritrocitos y macrófagos, hemorragias y engrosamiento de la pared alveolar, probablemente secundario a una inestabilidad capilar (D). En conjunto, estos resultados sugieren que HIF2 juega un papel inhibitorio sobre células vasculares cardiacas y pulmonares que previene un remodelado microvascular excesivo y disfunción de estos órganos en respuesta a hipoxia.